Pourquoi le fluor ne peut-il pas être l'atome central des composés interhalogènes?
Tout d'abord, le fluor peut être au «centre des choses». Les exemples incluent l'acide fluorhydrique fortement lié à l'hydrogène

et l ' exemple très pertinent de l' anion trifluorure
$$ \ ce {[FFF] ^ -} $$
L'exemple d'anion trifluorure est critique car il démontre que le fluor peut être hypercoordonné (hypervalent). Bien sûr, dans ce dernier exemple, nous avons "trompé" le fluor pour qu'il occupe la position médiane, donc votre question reste (légèrement modifiée), pourquoi le fluor n'occupe-t-il pas plus souvent une position centrale?
Dans Pour répondre à cette question, deux cas généraux doivent être considérés,
- La situation anionique $ \ ce {[XFX] ^ -} $ vs. $ \ ce {[XXF] ^ -} $
- La situation cationique $ \ ce {[XFX] ^ +} $ vs. $ \ ce {[XXF] ^ +} $
où X est Cl, Br ou I.
Dans le cas de l'anion, les structures de points de Lewis suggèrent une charge négative sur l'atome central.
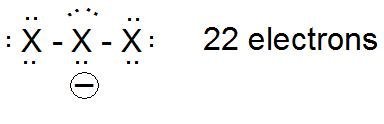
Cependant, l'analyse computationnelle de la distribution électronique dans l ' anion triiodure (voir p. 156) suggère que l'atome central est chargé positivement (+0,27 électron), tandis que les atomes terminaux sont chargés négativement (-0,63 électrons sur chaque atome terminal). En supposant que la même tendance générale serait applicable aux anions trihalogénures mixtes, alors dans le cas de $ \ ce {[XFX] ^ -} $ nous placerions une charge positive sur un atome de fluor hautement électronégatif au lieu du plus grand, plus polarisable (par exemple plus capable de porter une charge positive) atome de brome, de chlore ou d'iode.
Dans le cas du cation, des arguments similaires entrent en jeu. Encore une fois, les calculs pour une variété de cations trihalogénures (mixtes et homogènes) suggèrent une charge positive substantielle sur l'atome central (cette fois en accord avec les structures de Lewis Dot). Les mêmes arguments avancés ci-dessus fonctionneraient ici pour déstabiliser des structures avec un atome central de fluor. Cette analyse a également révélé des liaisons extrêmement longues (moins stabilisantes) lorsque le fluor (ou le plus électronégatif des 3 atomes) occupait la position centrale.
Arguments qui n'expliquent pas le les rares apparitions de fluor en position centrale dans les composés interhalogénés comprennent:
- le manque de "d-orbitales" ; comme d'autres l'ont commenté, c'est un ancien argument invalide; l'existence de $ \ ce {F3 ^ -} $ démontre que le fluor est capable de liaison hypercoordonnée sans avoir besoin d'une implication d-orbitale
- chevauchement inefficace 2p-3p ; $ \ ce {FCl} $ a une force de liaison plus élevée et une chaleur de formation plus faible que $ \ ce {Cl2} $